Se trata del segundo linfoma de bajo grado de mayor incidencia en países occidentales después del linfoma MALT (Tejido linfoide asociado a mucosas).
Comprende el 39% de los linfomas No Hodgkin, se presenta en la edad adulta con pico de incidencia a los 59 años, sin embargo también ocurre a edades mas tempranas.
Ligero predominio en el sexo femenino con una relación 1:1.7.
Los lugares que mas comúnmente están involucrados son los ganglios linfáticos, aunque algunas veces pueden involucrarse sitios extra nodales como el tracto gastrointestinal, especialmente el duodeno, piel, tiroides, glándula salival, mama y testículos.
Características clínicas:
Es una enfermedad heterogénea, en algunos casos son indolentes, pero otros no lo son. Estos últimos son los que pueden sufrir transformación histologica a linfoma difuso de alto grado y exhibir un curso agresivo. La transformación maligna ocurre en aproximadamente 30-40% de los pacientes, en una tasa de 3% por año.
La mayoría de los pacientes con linfoma folicular están en estadios avanzados y la enfermedad se encuentra diseminada al momento del diagnostico, incluyendo ganglios linfáticos, abdominales y bazo. Si la enfermedad es localizada se presentara como crecimiento ganglionar o puede ser asintomática.
Patogenesis:
El desarrollo de la mayoría de los linfomas depende de la sobrexpresión de BCL-2 localizado en el cromosoma 18q21. BCL-2 es un oncogen que bloquea la muerte celular programada (apoptosis); por lo tanto la sobre expresión incrementa la supervivencia celular.
Esta translocación cromosomica coloca al gen de BCL-2 bajo el control del potenciador de la cadena pesada de inmunoglobulina (IgH). Análisis de la secuencia del punto de ruptura indican que esta translocación se genera durante un error en el rearreglo fisiológico de VDJ en el gen de la cadena pesada de inmunoglobulina. Esta aberración genética resulta en expresión constitutiva de BCL2 y confiere ventaja en la supervivencia de las células B, una importante característica en la patogenesis. de LF.
Sin embargo t(14;18) por si sola no es suficiente para el desarrollo de LF, ya que individuos sanos en algunas ocasiones tienen una pequeña población de células B positivas para t(14;18). Hoy en día se reconoce que varias anormalidades genéticas participan para el desarrollo de LF, se asume que lo anterior es es la razón por la heterogeneidad clínica de esta enfermedad (tabla 1).
Aunado a estas alteraciones genéticas, se han encontrado alteraciones moleculares que se relacionan con modificaciones en el programa epigenetico que controla células B del centro germinal.
Características histologicas e inmunofenotipo:
La contraparte normal del linfoma folicular son células B derivadas del centro germinal, tanto centrocitos y centroblastos que forman estructuras foliculares. Los folículos neoplásicos tienen bordes poco definidos y la zona del manto es escasa o esta ausente. Los folículos normales tienen macrofagos con cuerpos teñibles pero los neoplásicos con grado I O II no lo tienen y tienen apariencia monotona.
Pueden mostrar una variedad importante de patrones, difuso, diferenciación de la zona marginal, etc.
Que las células derivan del centro germinal es apoyado por la identificación de mutaciones somáticas en la región variable de los genes de la inmunoglobulina (IgVH), que sirve como marcador de transito por el centro germinal y el inmunofenotipo de las células tumorales, que en la mayoría de los aspectos se asemeja estrechamente a las células B del centro folicular.
Por inmunohistoquimica (Tabla 2) , las células tumorales son positivas para marcadores B como CD20, CD79a y negativos para marcadores T como CD3 y CD5. Reflejando su origen del cento germinal, las células tumorales son positivas para CD10 y BCL-6. Pese a que en los folículos normales BCL-2 se encuentra regulado a la baja causando apoptosis en las células B no seleccionadas, las células tumorales siempre expresan BCL-2 por t(14;18)/IgH-BCL2. Aunque en algunas series hasta el 10% son negativos para BCL-2.
Gradificación:
En la ultima revisión de la clasificación de la OMS se aceptan los siguientes niveles de gradificación;
Diagnostico diferencial:
Tabla 1.
Tabla 2.
Pronostico y tratamiento:
El estudio FLIP2 mostro cinco factores de riesgo de progresión:
La mayoría de los pacientes con linfoma folicular están en estadios avanzados y la enfermedad se encuentra diseminada al momento del diagnostico, incluyendo ganglios linfáticos, abdominales y bazo. Si la enfermedad es localizada se presentara como crecimiento ganglionar o puede ser asintomática.
Patogenesis:
El desarrollo de la mayoría de los linfomas depende de la sobrexpresión de BCL-2 localizado en el cromosoma 18q21. BCL-2 es un oncogen que bloquea la muerte celular programada (apoptosis); por lo tanto la sobre expresión incrementa la supervivencia celular.
Esta translocación cromosomica coloca al gen de BCL-2 bajo el control del potenciador de la cadena pesada de inmunoglobulina (IgH). Análisis de la secuencia del punto de ruptura indican que esta translocación se genera durante un error en el rearreglo fisiológico de VDJ en el gen de la cadena pesada de inmunoglobulina. Esta aberración genética resulta en expresión constitutiva de BCL2 y confiere ventaja en la supervivencia de las células B, una importante característica en la patogenesis. de LF.
Sin embargo t(14;18) por si sola no es suficiente para el desarrollo de LF, ya que individuos sanos en algunas ocasiones tienen una pequeña población de células B positivas para t(14;18). Hoy en día se reconoce que varias anormalidades genéticas participan para el desarrollo de LF, se asume que lo anterior es es la razón por la heterogeneidad clínica de esta enfermedad (tabla 1).
Aunado a estas alteraciones genéticas, se han encontrado alteraciones moleculares que se relacionan con modificaciones en el programa epigenetico que controla células B del centro germinal.
Características histologicas e inmunofenotipo:
La contraparte normal del linfoma folicular son células B derivadas del centro germinal, tanto centrocitos y centroblastos que forman estructuras foliculares. Los folículos neoplásicos tienen bordes poco definidos y la zona del manto es escasa o esta ausente. Los folículos normales tienen macrofagos con cuerpos teñibles pero los neoplásicos con grado I O II no lo tienen y tienen apariencia monotona.
Pueden mostrar una variedad importante de patrones, difuso, diferenciación de la zona marginal, etc.
Que las células derivan del centro germinal es apoyado por la identificación de mutaciones somáticas en la región variable de los genes de la inmunoglobulina (IgVH), que sirve como marcador de transito por el centro germinal y el inmunofenotipo de las células tumorales, que en la mayoría de los aspectos se asemeja estrechamente a las células B del centro folicular.
Por inmunohistoquimica (Tabla 2) , las células tumorales son positivas para marcadores B como CD20, CD79a y negativos para marcadores T como CD3 y CD5. Reflejando su origen del cento germinal, las células tumorales son positivas para CD10 y BCL-6. Pese a que en los folículos normales BCL-2 se encuentra regulado a la baja causando apoptosis en las células B no seleccionadas, las células tumorales siempre expresan BCL-2 por t(14;18)/IgH-BCL2. Aunque en algunas series hasta el 10% son negativos para BCL-2.
Gradificación:
En la ultima revisión de la clasificación de la OMS se aceptan los siguientes niveles de gradificación;
- Grado 1 y 2: bajo grado; 0-15 centroblastos/campo de alto poder
- Grado 3A: presencia de cenrocitos
- Grado 3B: ausencia de centrocitos.
Es importante distinguir entre 3A y 3B debido a que existen diferencias aparentes en el pronostico clínico y en el ámbito genético y molecular entre ambos grupos.
 |
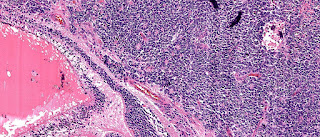
En vista panoramica se observan folículos neoplásicos con bordes mal definidos..
.
|
 |
| Mayor aumento se observan bordes mal definidos, zona del manto
escasa y casi ausente,
|
 |
En esta folículo, se observan células monomorfas,
Se ha perdido la polarización normal (con centrocitos
en una zona clara y centroblastos en una zona obscura)
de un folículo secundario.
|
 |
| Campo de alto poder, linfoma folicular Grado 1 con células tumorales están compuestas de células pequeñas centrocitos y en menor cuantía centroblastos. |
Diagnostico diferencial:
Linfomas de bajo grado compuestas por estructuras nodulares deben ser diferenciadas; entre estas encontramos linfoma de células B de la zona marginal, linfoma de las células del manto y leucemia linfocitica crónica/linfoma de linfocitos pequeños.
Tabla 1.
Gen
|
Frecuencia
|
BCL-2
|
85% (translocación)
|
96% (mutación)
|
|
MLL2
|
89%
|
EPHA7
|
70%
|
BCL-6
|
47% (mutación)
|
6-14% translocación
|
|
TNFRSF14
|
18-46%
|
CREBBP
|
33%
|
MEF2B
|
15%
|
EP300
|
9%
|
EZH2
|
7%
|
TNFAIP3/A20
|
2-26%
|
FAS
|
6%
|
TP53
|
<5%
|
Tabla 2.
|
Anticuerpos
|
Comentario
|
|
CD3
|
Negativo
|
|
CD19
|
Positivo
|
|
CD20
|
Positivo
|
|
CD10
|
Positivo
|
|
BCL-2
|
Positivo (algunas lesiones de mayor grado suelen ser
negativos)
|
|
BCL-6
|
Positivo
|
|
CD23
|
Usualmente negativo
|
|
CD79a
|
Positivo
|
|
CD5
|
Negativo
|
|
MUM-1
|
Negativo (en algunas lesiones de mayor grado suele ser positivo)
|
|
Ki-67
|
Variable
|
|
Ciclina
D1
|
negativo
|
Pronostico y tratamiento:
El estudio FLIP2 mostro cinco factores de riesgo de progresión:
- Beta 2 microglobulina elevada
- involucro de medula osea
- hemoglobina <12g/dl
- Nodulo linfatico mas grande de mas de 6cm
- Edad <60 años.
Sin factores de riesgo 80% 5 años de supervivencia, 1 a 2 factores de riesgo; 51% supervivencia a 5 años, 3 a 5 factores de riesgo: 19%.
Tratamiento:
Radiación en estadios I/II
Rituximab mas quimioterapia
Transplante autologo de celulas madre.